科学家们发现了冠状病毒的致命弱点
SARS-CoV-2基因组的一个独特特征是控制蛋白质合成,是病毒的致命弱点。
病毒需要受感染细胞的资源来复制,然后感染更多的细胞,然后转移给其他个体。病毒生命周期中的一个重要步骤是根据病毒RNA基因组中的指令产生新的病毒蛋白。按照这些构建计划,细胞自身的蛋白质合成机器,称为核糖体,会产生病毒蛋白质。
在没有病毒感染的情况下,核糖体以严格定义的步骤沿着 RNA 移动,一次读取三个 RNA 字母。这个由三个字母组成的代码定义了与正在生长的蛋白质相连的相应氨基酸。核糖体几乎从未发生过向前或向后滑动一两个 RNA 字母,而不是遵循常规的三字母步骤。当核糖体发生这种滑动时,它被称为“移码”,它会导致对遗传密码的错误读取。
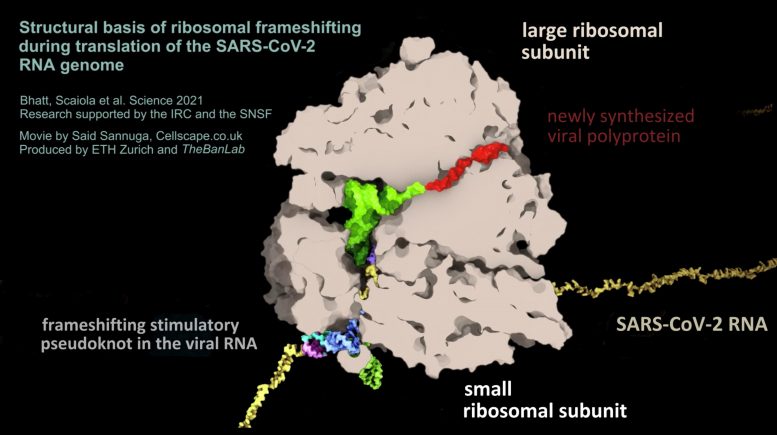
SARS-CoV-2 病毒的 RNA(黄色)形成假结结构(彩色,右下),导致核糖体(棕色)的阅读框发生变化。通过这种方式,病毒 RNA 控制病毒蛋白的生产水平。图片来源:Said Sannuga,Cellscape.co.uk / 苏黎世联邦理工学院,禁令实验室
移码几乎从未在我们的细胞中发生。它会导致功能失调的细胞蛋白;然而,某些病毒,如冠状病毒和 HIV,依赖于移码事件来调节病毒蛋白的水平。例如,SARS-CoV-2(导致COVID-19的病毒)严重依赖于病毒 RNA 中不寻常且复杂的折叠所促进的移码。
因此,由于移码对病毒至关重要,但它几乎从未在我们的生物体中发生,因此任何通过靶向这种 RNA 折叠来抑制移码的化合物都可能用作抗感染的药物。然而,到目前为止,还没有关于病毒 RNA 如何与核糖体相互作用以促进移码的信息,这对于药物开发很重要。
冠状病毒复制的基本过程的详细图像
来自苏黎世联邦理工学院和伯尔尼大学、洛桑大学(瑞士)和科克大学(爱尔兰 UCC)的一组研究人员首次设法揭示了病毒基因组和核糖体在移码过程中的相互作用。他们的研究结果刚刚发表在《 科学》杂志上。
通过复杂的生化实验,研究人员设法在 SARS-CoV-2 RNA 基因组的移码位点捕获了核糖体。然后他们可以使用低温电子显微镜研究这种分子复合物。
结果以前所未有的细节提供了对该过程的分子描述,并揭示了许多新的意想不到的特征。移码事件导致通常动态的核糖体机器采用应变构象,这有助于提供哺乳动物核糖体最清晰和最准确的图像之一,在移码过程中可视化,同时从病毒基因组中读取信息。然后,研究人员通过体外和体内实验跟进他们的结构发现,包括探索如何用化合物靶向这一过程。苏黎世联邦理工学院分子生物学教授、该研究的合著者 Nenad Ban 强调,“这里提出的关于 SARS-CoV-2 的结果也将有助于理解其他 RNA 病毒的移码机制”。
抗病毒药物开发的可能靶点
SARS-CoV-2 对这种核糖体移码事件的依赖性可用于开发抗病毒药物。先前的研究报告说,几种化合物能够抑制冠状病毒的移码,但是,这项研究现在提供了有关这些化合物对感染细胞中 SARS-CoV-2 水平的影响的信息。
在他们的实验中,这两种化合物都将病毒复制减少了三到四个数量级,并且对处理过的细胞没有毒性。然而,两者中的一个通过抑制核糖体移码来减少病毒复制,而另一个可能通过不同的机制起作用。
相关设备推荐: 显微镜模块
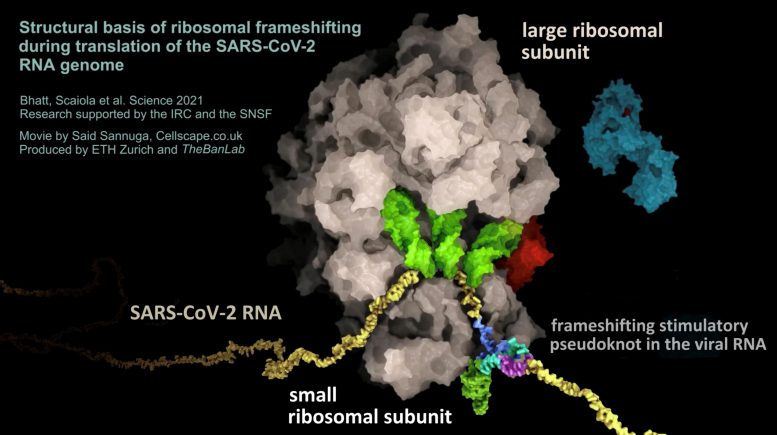
SARS-CoV-2 病毒的 RNA(黄色)形成假结结构(彩色,右下),导致核糖体(棕色)的阅读框发生变化。通过这种方式,病毒 RNA 控制病毒蛋白的生产水平。图片来源:Said Sannuga,Cellscape.co.uk / 苏黎世联邦理工学院,禁令实验室
尽管这些化合物目前还不足以用作治疗药物,但这项研究表明,抑制核糖体移码对病毒复制具有深远的影响,这为开发更好的化合物铺平了道路。由于所有冠状病毒都依赖于这种保守的移码机制,针对这一过程的药物甚至可能有助于治疗更远亲的冠状病毒感染。“我们未来的工作将集中在了解抑制病毒移码的细胞防御机制,因为这可能有助于开发具有相似活性的小化合物,”Ban 说。

